Die Autorinnen haben, unabhängig voneinander, beide im Bereich Patient Affairs gearbeitet und dabei logischerweise nicht über, sondern vor allem mit Patienten gesprochen (hier im Sinne von Menschen mit chronischen Erkrankungen, wie z.B. des rheumatischen Formenkreises oder mit neurologischen Erkrankungen). Bei jedem Gespräch wurde schnell klar: Das Thema „neue Medikamente“ interessiert Patienten an erster Stelle. Nachvollziehbar, liegen doch riesengroße Hoffnungen und Erwartungen darauf, dass nicht nur den Betroffenen, sondern zumindest der nachfolgenden Patientengeneration geholfen werden könnte. Vielleicht kann die eine oder andere chronische Erkrankung gar irgendwann geheilt werden? (Das dies, wenngleich auch selten, möglich ist, zeigt der Beitrag über Hepatitis C „Heilung durch hochpreisige Innovationen“ vom 29. 3. 2018 in diesem Blog.)
Das Wissen, wie ein neues Medikament entsteht, ist in der Bevölkerung relativ dünn. Die Initiative EUPATI will das ändern.
EUPATI steht für „Europäische Patientenakademie zu therapeutischen Innovationen“. Start war 2012. EUPATI wurde als europäische Initiative unter Leitung des European Patient Forum (EPF) aus der Taufe gehoben von akademischen Einrichtungen, forschenden Pharmaunternehmen gemeinsam mit einigen großen und aktiven Patientenorganisationen (der European Genetic Alliance, der European AIDS Treatment Group und EURORDIS – Rare Diseases Europe) unter Förderung durch die Innovative Medicines Initiative.[1]
Das Projekt wurde für fünf Jahre mit insgesamt 10 Millionen Euro ausgestattet, 5 Millionen stammen aus EU-Mitteln, 5 Millionen finanziert die Pharmaindustrie.
Welches Ziel hat EUPATI?
EUPATI hat nach eigener Darstellung das Ziel, „die Fähigkeit von Patienten, die medizinische Forschung und Entwicklung zu verstehen und sich daran zu beteiligen, auszubauen und zudem die Verfügbarkeit objektiver, zuverlässiger und patientenfreundlicher Informationen für die Öffentlichkeit zu verbessern.“[2]
Zudem sollen Patienten befähigt werden, als gut informierte Fürsprecher und Berater aufzutreten, um andere Patientengruppen zu informieren und um öffentliches Bewusstsein für die Entwicklung neuer Therapien herzustellen.[3]
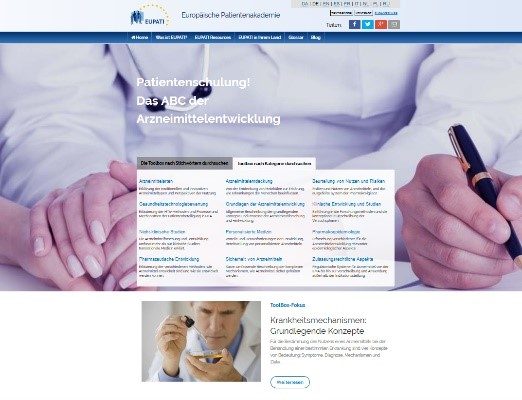
Was ist die EUPATI Toolbox?
Anfang 2016 wurde die Landesplattform von EUPATI in Deutschland gegründet. Zur gleichen Zeit wurde die EUPATI-Toolbox in deutscher Sprache veröffentlicht: Sie enthält eine Sammlung von Texten und Videos, die den Prozess der Entwicklung und Zulassung von Arzneimitteln für Patienten erläutern sollen. Unter https://www.eupati.eu/de/ sind unter dem Stichwort „Patientenschulung – Das ABC der Arzneimittelentwicklung“ Begriffe wie „Arzneimittelarten“, „Gesundheitstechnologiebewertung“ bis hin zu „Zulassungsrechtliche Aspekte“ erklärt.
Ein sinnvolles Projekt, das aus Sicht der chronisch erkrankten Menschen als auch aus Sicht der Pharmaindustrie eine win-win-Situation darstellen könnte: Je mehr Menschen und Patienten über das komplexe Thema klinische Studien, deren Ziel und Hintergründe wissen, desto eher sind sie bereit, an klinischen Studien teilzunehmen, ohne sich als „Versuchskaninchen“ zu fühlen. Zudem können Patienten ihre Erfahrungen und Bedürfnisse im Zusammenhang mit der Erkrankung – kurz, ihre erlebte Kompetenz – bereits frühzeitig in die Planung von klinischen Studien einbringen und damit die Forschung patientenzentrierter machen. Das Verständnis für die Forschung wird erhöht, und von geschulten Patienten kann das erworbene Wissen und das Verständnis für klinischen Studien an weitere Patienten weitergetragen werden.
Denn Studien sind, das sei an dieser Stelle nochmals betont, zwingend notwendig für die Entwicklung und Zulassung eines innovativen Arzneimittels.
Also win-win für die Industrie und die Patienten?
Noch bevor die deutsche Landesplattform gegründet war, regte sich Kritik: Im März 2015 veröffentlichte Spiegel Online einen siebenteiligen kritischen Beitrag zur Europäischen Pharmaforschung. Teil 5: „Patienten werden zu Lobbyisten der Industrie“ [4]. Einziger Kritikpunkt: „Wenn der europäische Pharmaverband (EFPIA) bei der IMI hinter dem Steuer sitzt, nehmen Patientenvertreter auf dem Beifahrersitz Platz.“ Allein aus den Tatsachen, dass Patientenvertreter geschult werden sollen, Prozesse in der Arzneimittelentwicklung besser zu verstehen, und sich Pharmakonzerne als ausgewiesene Spezialisten – neben anderen Organisationen wohlgemerkt – in EUPATI engagieren, wird eine Beeinflussung impliziert. Diese Skepsis wird nahezu reflexartig ausgesprochen.
Dabei wird Misstrauen doch vor allem durch Nichtwissen geschürt, oder, wie es 2016 der damalige EUPATI-Koordinator Jan Geißler in einem Interview mit der Plattform „Pharma-Fakten“ [5] ausdrückte:
„Bildung war schon immer ein wirksames Mittel gegen Einflussnahme.“
Auch Peter Lack, von 2014 bis 2018 Geschäftsführer der Patienten-Dachorganisation „Kinderkrebs Schweiz“ und Absolvent des ersten EUPATI-Lehrgangs, gibt zu, dass es natürlich für naturwissenschaftliche Laien schwer zu durchschauen ist, wenn Informationen nicht objektiv sind. Aber es gibt sowohl Patientenvertreter mit Kenntnissen zu ethischen Belangen als auch Patientenvertreter mit einem Life-Science-Background. Auch die Kompetenzen der Patienten sollten nicht unterschätzt werden.[6] Zudem weisen EUPATI-Vertreter auf die vielfältigen Überprüfungen des Bildungsmaterials durch vielerlei Instanzen hin.
Kritische Stellungnahme
Vom Deutschen Netzwerk Evidenzbasierte Medizin e.V. (DNEbM) und der Patientenvertretung im Gemeinsamen Bundesausschuss (G-BA) gab es am 30. Mai 2016 eine weitere kritische Stellungnahme zur EUPATI-Toolbox, die sich etwas ausführlicher als eine pauschale Aburteilung mit den Mindestanforderungen an die Erstellung von verständlichen Informationen für Patient*innen beschäftigt.[7] Bemängelt werden die fehlende Dokumentation des methodischen Vorgehens, die ungeeignete sprachliche und redaktionelle Umsetzung sowie die fehlende kritische Diskussion von kritischen Aspekten der Arzneimittelanwendung.
EUPATI-Leitsätze
Wohl um sich vor allem gegen den Vorwurf der übermäßigen Beeinflussung der Patientenexperten im Sinne der Industriepartner gibt sich EUPATI selbst Leitsätze: Auf der Webseite der Initiative finden wir die „Leitlinie für die Beteiligung von Patienten in Forschung und Entwicklung“.[8] Diese Leitsätze bauen auf den Grundsätzen Relevanz, Fairness, Gleichheit und Vermittlung von Wissen und Handlungskompetenzen auf. Umgesetzt werden sollen diese Grundsätze durch definierte Arbeitspraktiken, wie z.B.
- die Organisation der Patientenbeteiligung mit einer definierten Kontaktstelle innerhalb der Unternehmen,
- der vorherigen Festlegung des beiderseitigen Nutzens,
- der vorherigen Definition aller Details über eine Interaktion zwischen einzelnen Patienten oder Vertretern von Patientenorganisationen und Industrieunternehmen
- der schriftlichen Fixierung von
- Typ, Umfang, Ressourcenanforderungen und Zeitplänen vor jeder Interaktion,
- Ziel, Art der Beiträge, Werkzeuge und Methoden der Interaktion,
- Verwendung der Ergebnisse und Eigentumsrechte,
- Information der/des beteiligten Patienten/-in über die Ergebnisse,
- Vertragsbedingungen einschließlich Einwilligung und Aufwandsentschädigung/Vergütung.
Als Ausgangsmaterial für diese Leitlinie wurden eine Anzahl anerkannter Kodizes (z.B. der EMA, der FDA oder das ECAB Protocol)[9] herangezogen. Die EUPATI Leitlinien zur Patientenbeteiligung wurden von Projektmitgliedern und allen Konsortiumspartnern eingehend überprüft, ehe sie zur öffentlichen Konsultation freigegeben wurden. Die Kommentare von Teilnehmern an zwei Reviewrunden bestätigen, dass diese Leitlinien robust und für eine Umsetzung geeignet sind.
Wie ist der aktuelle Status Quo, und wie geht es weiter?
Die Auseinandersetzungen um die Objektivität der Informationen stammen nach Recherchen zum größten Teil aus dem Jahr 2016. Aktuellere Stellungnahmen waren nicht zu finden. Leider war trotz mehrerer Anfrage an EUPATI Deutschland zu Beginn des Jahres 2019 nicht zu erfahren, inwieweit es nach der Stellungnahme von DNEbM und Patientenvertretung des G-BA zu Änderungen in der Toolbox wie der sprachlichen Anpassung an die Zielgruppe kam. Die Autorin hat sich selbst in der Toolbox umgesehen und findet die Inhalte gut und verständlich (aber sie ist ja auch „befangen“).
Zurzeit gibt es nach wie vor die Möglichkeit, dass Patienten und Patientenvertreter aus ganz Europa sich in einem 14monatigen Patientenexperten-Trainingskurs mit sechs e-Learning-Modulen und zwei ergänzenden interaktiven Trainingswochen zum Patientenexperten ausbilden lassen. Inhalte des Kurses sind u.a. präklinische Forschung, Design und Ziele klinischer Studien, Risiko-Nutzen-Analyse und Nutzenbewertung bis hin zur Marktzulassung eines neuen Arzneimittels. Der Kursinhalt wurde vom EUPATI-Konsortium[10] im Rahmen eines soliden Produktions- und Qualitätssicherungsprozesses entwickelt. Interessierte werden anhand ihrer Vorkenntnisse, ihres Indikationsgebietes, des Herkunftslandes und eines Motivationsschreibens ausgewählt. Ein Wermutstropfen für interessierte Patienten, Angehörige oder Patientenvertreter: Die Kurssprache ist ausschließlich Englisch. Insgesamt sind seit Oktober 2014 und Dezember 2018 drei Kurse mit insgesamt 153 Absolventen abgeschlossen worden.[11] Für EUPATI Deutschland sind derzeit fünf Patientenexpertinnen aufgeführt;[12] ein oben auf der Seite angekündigtes Formular zur Kontaktaufnahme ist allerdings nicht zu finden.
Die Patientenorganisationen in Deutschland reagieren unterschiedlich auf die Initiative: So herrscht z.B. beim Vorstand der größten deutschen Patientenorganisation Skepsis; andere, wie z.B. die Jungen Parkinsonkranken Oberpfalz, verlinken im Serviceteil ihrer Webseiten auf die EUPATI-Toolbox.
Wissen über Krankheiten und Medikamente
Krank werden kann jeder. Mehr Wissen um Arzneimittelforschung und die Entwicklung von Medikamenten und ein Dialog zwischen Patienten und Forschenden kann diese Forschung fokussierter und patientenzentrierter machen. So ein Wissen fehlt in weiten Kreisen der Bevölkerung. Sind einzelne Industrieunternehmen durch ihre Kodizes beim Zugehen auf Patienten begrenzt, können diese Grenzen durch die beschriebene gemeinsame Initiative mit Patientenorganisationen und akademischen Einrichtungen überwunden werden. Gehen die Autorinnen nach ihrem Bekanntenkreis außerhalb der beruflichen Kreise, ist EUPATI allerdings kaum jemandem bekannt. So ein Wissensschatz kann noch viel mehr genutzt werden. Schade!
[1] IMI; http://www.imi.europa.eu/
[2] https://www.eupati.eu/de/was-ist-eupati/
[3] https://www.eupati.eu/de/laden-sie-den-eupati-kurs-zur-schulung-von-patientenexperten-herunter/
[4] http://www.spiegel.de/wissenschaft/medizin/imi-umstrittenes-eupati-projekt-schult-patientenvertreter-a-1021709.html, Zugriff 15.02.2019
[5] www.pharma-fakten.de ist eine Initiative der Pharmaindustrie für eine sachliche Diskussion mit hoher inhaltlicher Qualität.
[6] https://www.srf.ch/sendungen/puls/gesundheitswesen/umstrittene-patientenschulung-wer-profitiert-von-eupati, Zugriff 13.02.2019
[7] https://www.ebm-netzwerk.de/aktuelles/news2016-05-30/, Zugriff 8.03.2019
[8] https://www.eupati.eu/de/leitlinie-fur-die-beteiligung-von-patienten-in-forschung-und-entwicklung-fe/, Zugriff 18.02.2019
[9] Beschreibung und Arbeitsweise des ECAB (European Community Advisory Board der Therapie-Aktivistengruppe „European AIDS Treatment Group (EATG)“
[10] Mitglieder des Konsortiums sind Patientenorganisationen (wie z. B. EATG, European Genetic Alliance Network, European Patients Forum, EURORDIS – European Organisation for Rare Diseases), Akademische Einrichtungen (z. B. DIA – Develop Innovate Advance, The European Organisation for Research and Treatment of Cancer, Hibernia College) sowie dem Verband forschender Arzneimittelhersteller und 19 Mitgliedsunternehmen
[11] https://www.eupati.eu/eupati-training-course/, Zugriff 10.03.2019
[12] https://de.eupati.eu/patientenexperten/. Zugriff 10.03.2019
 Karen Thiel
Karen Thiel  Dr. Martina Hänsel
Dr. Martina Hänsel