Immer wieder werden Anwendungsbeobachtungen für Arzneimittel kritisiert. Gerade Transparency sieht die AWBs als Möglichkeit für Korruption und als Kauf von Verordnungen. (https://www.transparency.de/index.php?id=2564). Das stimmte sicherlich in früheren Zeiten. Selbst Generika-Unternehmen haben AWBs platziert, um Verordnungen zu generieren. Die Ergebnisse waren meist nicht verwertbar und wurden auch nicht veröffentlicht. Aber es hat sich viel getan. Stimmt diese Behauptung immer noch?
AWB, NIS, PASS – Wo liegen die Unterschiede?
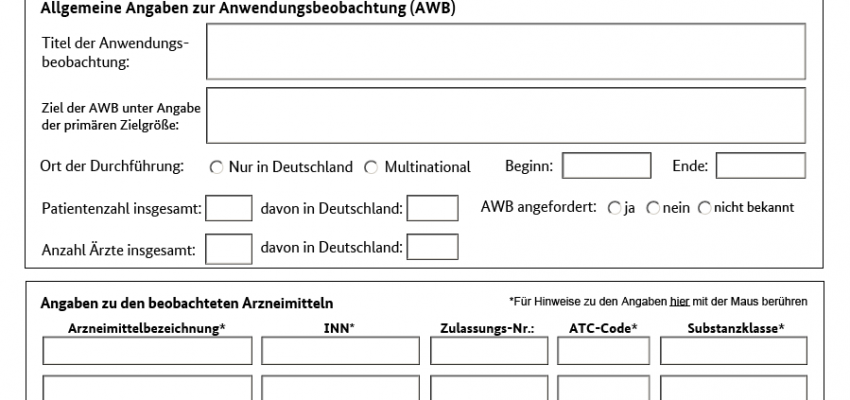
Anwendungsbeobachtungen (AWBs) sind Untersuchungen, die dazu bestimmt sind, Erkenntnisse bei der Anwendung zugelassener oder registrierter Arzneimittel zu sammeln. Anwendungsbeobachtungen sind eine Untergruppe der nichtinterventionellen Prüfungen im Sinne von § 4 Absatz 23 Satz 3 Arzneimittelgesetz (AMG). AWB sind nicht genehmigungspflichtig. Nach § 67 Absatz 6 AMG treffen den Durchführenden jedoch gegenüber der zuständigen Bundesoberbehörde Anzeige- und Übermittlungspflichten. Nach § 67 Absatz 6 Satz 10 AMG stellt die zuständige Bundesoberbehörde die ihr übermittelten Anzeigen und Abschlussberichte im Internet der Öffentlichkeit zur Verfügung.
Nichtinterventionelle Prüfungen (NIS = Not Interventional Study) sind definiert als Untersuchungen, in deren Rahmen „Erkenntnisse aus der Behandlung von Personen mit Arzneimitteln anhand epidemiologischer Methoden analysiert werden; dabei folgt die Behandlung einschließlich der Diagnose und Überwachung nicht einem vorab festgelegten Prüfplan, sondern ausschließlich der ärztlichen Praxis; soweit es sich um ein zulassungspflichtiges oder nach § 21a Absatz 1 AMG genehmigungspflichtiges Arzneimittel handelt, erfolgt dies ferner gemäß den in der Zulassung oder der Genehmigung festgelegten Angaben für seine Anwendung“.
Welche Untergruppen der nichtinterventionellen Studien gibt es?
- Anwendungsbeobachtungen (AWB)
- Kohorten-Studien
- Fall-Kontroll-Studien
- Register-Studien
- Post-Authorisation Safety Study (PASS)
Im Folgenden konzentrieren wir uns nur auf die AWB, denn sie stehen in der Kritik.
Warum AWBs überhaupt?
Einfach ausgedrückt: Man schaut dem Arzt über die Schulter, überprüft also den Einsatz des Arzneimittels im Markt. Beispiele: Wie wird es verordnet? Mit welchen anderen Präparaten wird das Arzneimittel häufig parallel verordnet? Wie ist das Anwendungsverhalten beim Patienten? Wie sehen die Patienten hinsichtlich Alter, Begleiterkrankungen etc. in Realität aus? So etwas kann in den klinischen Studien nicht überprüft werden, da es definierte Ein- und Ausschlusskriterien geben muss. Es sind also Alltagsbedingungen unter denen das Medikament beobachtet wird.
Registriert werden AWBs und alle anderen NIS seit 2007. Die Wahl des Registers war erst frei gestellt. Seit 2013 müssen sie in folgenden Registern veröffentlicht werden:
Register der AWBs seit 2013 beim BfArM: https://awbdb.bfarm.de/ords/f?p=101:20:::NO:::
Register beim PEI für AWBs zu Impfstoffen, Blutprodukten, gentechnischen Medikamenten und Mitteln zur Desensibilisierung: http://www.pei.de/DE/infos/pu/genehmigung-klinische-pruefung/anwendungsbeobachtungen/awb-datenbank-pei/awb-datenbank-node.html;jsessionid=88C6A29EB50B76BED7B41251E842967A.1_cid319
Warum werden Ärzte für AWBs bezahlt?
Von außen sieht es für Transparancy und die Medien so aus, als würden Ärzte viel Geld für wenig Arbeit bekommen und mit einer AWB nicht mehr frei in ihrer Verordnungsentscheidung sein. Die Vergütung für eine AWB, die durchaus aufwendig ist, richtet sich nach der GOÄ (Gebührenordnung für Ärzte). Die AWB und eine Liste der daran beteiligten Ärzte muss der kassenärztlichen Bundesvereinigung (KBV), den Spitzenverband Bund der Krankenkassen (SpiBu) mit Angabe der Vergütung angezeigt werden.
Ist wirklich noch davon auszugehen, dass AWBs allein aus monetären Gründen Verordnungsanreize für ein bestimmten Medikament hervorrufen? Vielleicht dann, wenn der entsprechende Arzt Behandlungserfolge bei seinen Patienten erkennt. Aber ist daran wirklich etwas falsch?
 Karen Thiel
Karen Thiel  Dr. Martina Hänsel
Dr. Martina Hänsel